Российские вакцины не прошли все фазы клинического исследования?
9 августа 2021, 19:24 [«Аргументы Недели», Константин Куликов ]
Клиническое исследование лекарственного препарата - изучение диагностических, лечебных, профилактических, фармакологических свойств лекарственного препарата в процессе его применения у человека, животного, в том числе процессов всасывания, распределения, изменения и выведения, путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного препарата, данных о нежелательных реакциях организма человека, животного на применение лекарственного препарата и об эффекте его взаимодействия с другими лекарственными препаратами и (или) пищевыми продуктами, кормами. (Федеральный закон от 12.04.2010 N 61-ФЗ "Об обращении лекарственных средств" Статья 4 Пункт 41)
Клинические исследования во всем мире являются неотъемлемым этапом разработки препаратов, который предшествует его регистрации и широкому медицинскому применению. В ходе клинических исследований новый препарат изучается для получения данных о его эффективности и безопасности. На основании этих данных уполномоченный орган здравоохранения принимает решение о регистрации препарата или отказе в регистрации.
Проведение клинических исследований в РФ регламентируют: Федеральный закон от 12.04.2010 N 61-ФЗ "Об обращении лекарственных средств" (Статья 40. Проведение клинического исследования лекарственного препарата для медицинского применения), ГОСТ Р 56701-2015 от 2016-07-01 ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ (УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 11 ноября 2015 г. N 1762-ст.), ГОСТ Р 52379-2005 от 2006-04-01 НАДЛЕЖАЩАЯ КЛИНИЧЕСКАЯ ПРАКТИКА (УТВЕРЖДЕН Приказом Федерального агентства по техническому регулированию и метрологии от 27 сентября 2005 года N 232-ст), Правила надлежащей клинической практики ОСТ 42-511-99 (согласно международного стандарта этических норм и качества научных исследований Good Clinical Practice; GCP), Приказ Минздрава России от 01.04.2016 N 200н "Об утверждении правил надлежащей клинической практики" (Зарегистрировано в Минюсте России 23.08.2016 N 43357), приказ Минздрава России от 09.01.2014 № 2н «Об утверждении порядка проведения оценки соответствия медицинских изделий в форме технических испытаний, токсикологических исследований, клинических испытаний в целях государственной регистрации медицинских изделий».
Обычно выделяют четыре фазы клинических испытаний. Фаза I. Цель этапа — убедиться, что препарат можно применять у людей. Фаза II. Цель этапа — дополнительно оценить безопасность лекарства и выяснить, работает ли препарат. Фаза III. Цель этапа — сравнить новый препарат со стандартным лечением. Фаза IV называется постмаркетинговой — этот этап клинического испытания начинается, когда готовое лекарство уже поступает в продажу.
Существует государственный реестр лекарственных средств, который содержит перечень лекарственных препаратов, прошедших государственную регистрацию (Федеральный закон от 12.04.2010 N 61-ФЗ "Об обращении лекарственных средств" Статья 33), другими словами реестр разрешений на проведение клинических исследований (РКИ).
В настоящий момент, у Российской Федерации известно существование нескольких вакцин от коронавируса: «Спутник V» и «Спутник Лайт» («Гам-КОВИД-Вак», Национального исследовательского центра эпидемиологии и микробиологии имени Н. Ф. Гамалеи), «ЭпиВакКорона» (Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии Вектор» Роспотребнадзора), «КовиВак» (Федерального научного центра исследований и разработки иммунобиологических препаратов имени М.П. Чумакова Российской академии наук).
«ЭпиВакКорона» на сайте государственного реестра лекарственных средств.
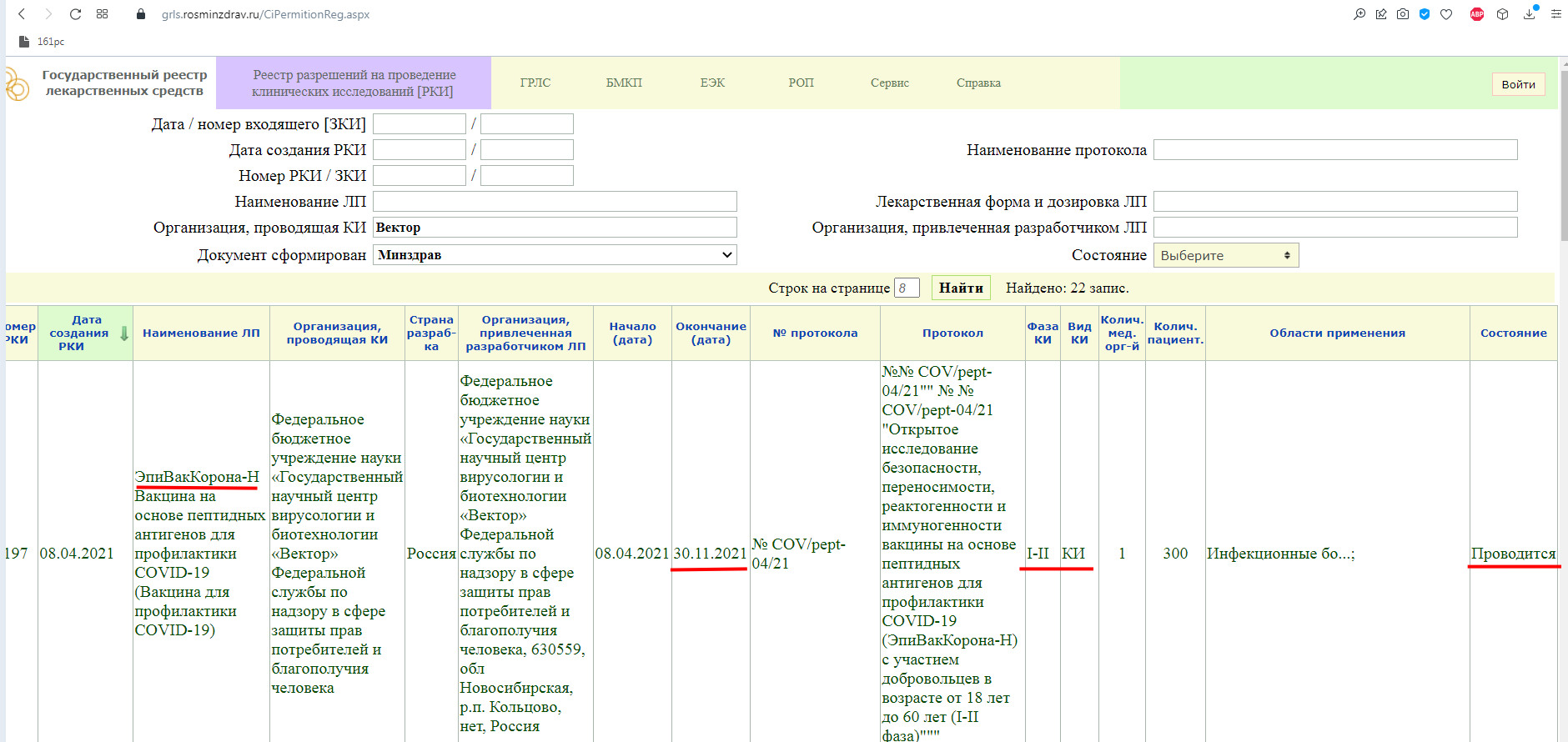
Как мы видим, в настоящий момент, проводится фаза клинического исследования 1-2 с участием добровольцев от 18 до 60 лет, и завершится она 30 ноября 2021 года.

Так же, проводится фаза клинического исследования 3-4 с участием добровольцев от 18 лет, и завершится она 31 августа 2021 года.

Завершенная фаза 3 клинического исследования, с участием добровольцев от 60 лет, и завершилась она 15 мая 2021 года. 
Фаза клинического исследования 1-2 с участием добровольцев от 18 до 60 лет, проводится до 30 декабря 2021 года.
Далее «КовиВак» на сайте государственного реестра лекарственных средств.

Тут так же видно, что проводится фаза клинического исследования 3 с участием добровольцев от 18 до 60 лет, и завершится она 30 декабря 2022 года.
«Спутник Лайт» на сайте государственного реестра лекарственных средств.
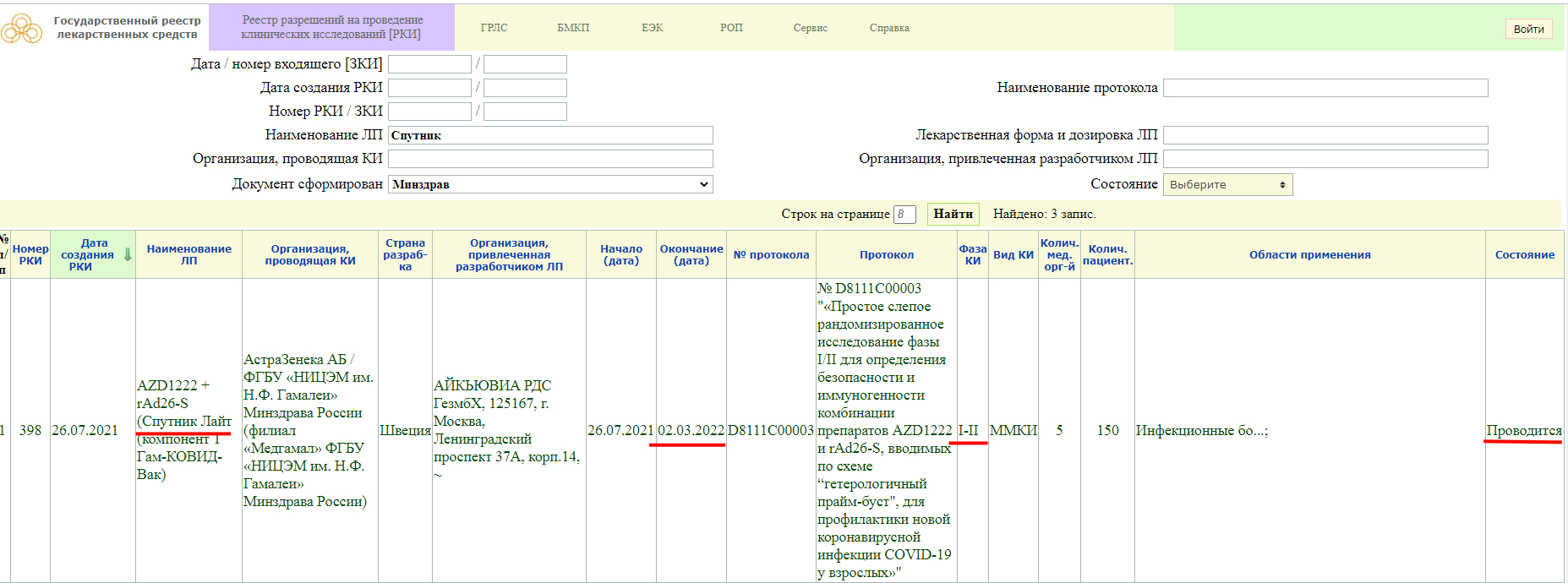
Как мы видим, в настоящий момент, у «Спутника Лайт» проводится фаза клинического исследования 1-2, и завершится она 2 марта 2022 года. Кстати обратите внимание, страна разработки Швеция.
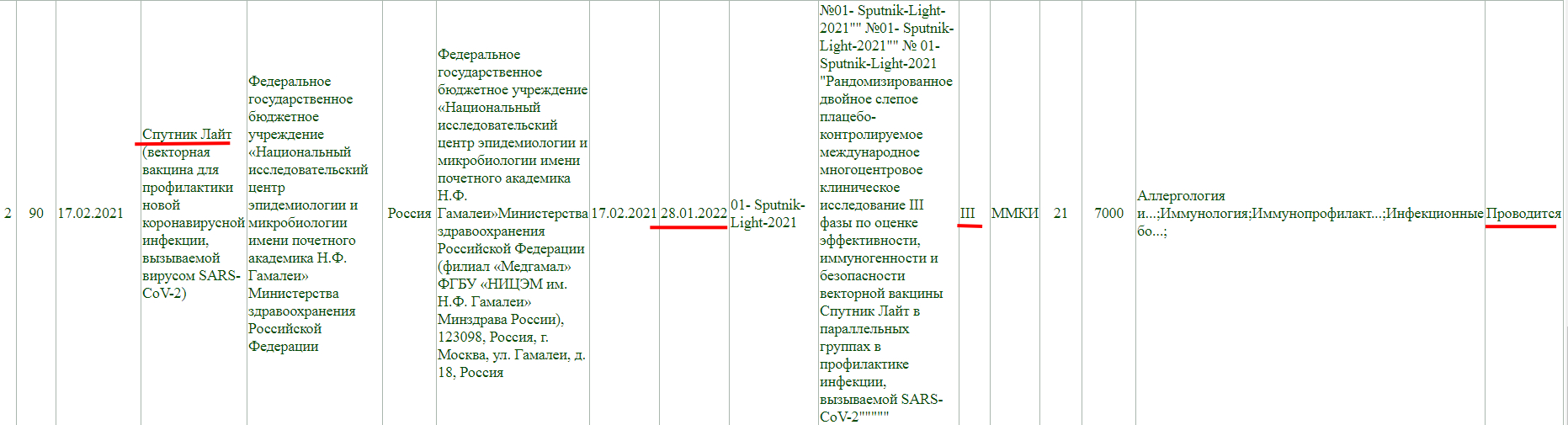
Так же, проводится фаза клинического исследования 3, и завершится она 28 января 2022 года.

Фаза клинического исследования 1-2, проводится до 31 декабря 2021 года.
В том числе и "Спутник V" («Гам-Ковид-Вак») на сайте государственного реестра лекарственных средств.
Важно отметить, что согласно разъяснениям Минздрава: «Гам-Ковид-Вак» и «Спутник V» - это одна и та же вакцина, у которой есть медицинское и коммерческое названия. Всем знакомая и понятная фраза «Спутник V» является торговым наименованием «Гам-Ковид-Вак.

Как и у остальных, клинические исследования не завершены, и в настоящий момент проводится фаза 3 с участием добровольцев от 18 до 60 лет, а завершится она 30 декабря 2022 года.
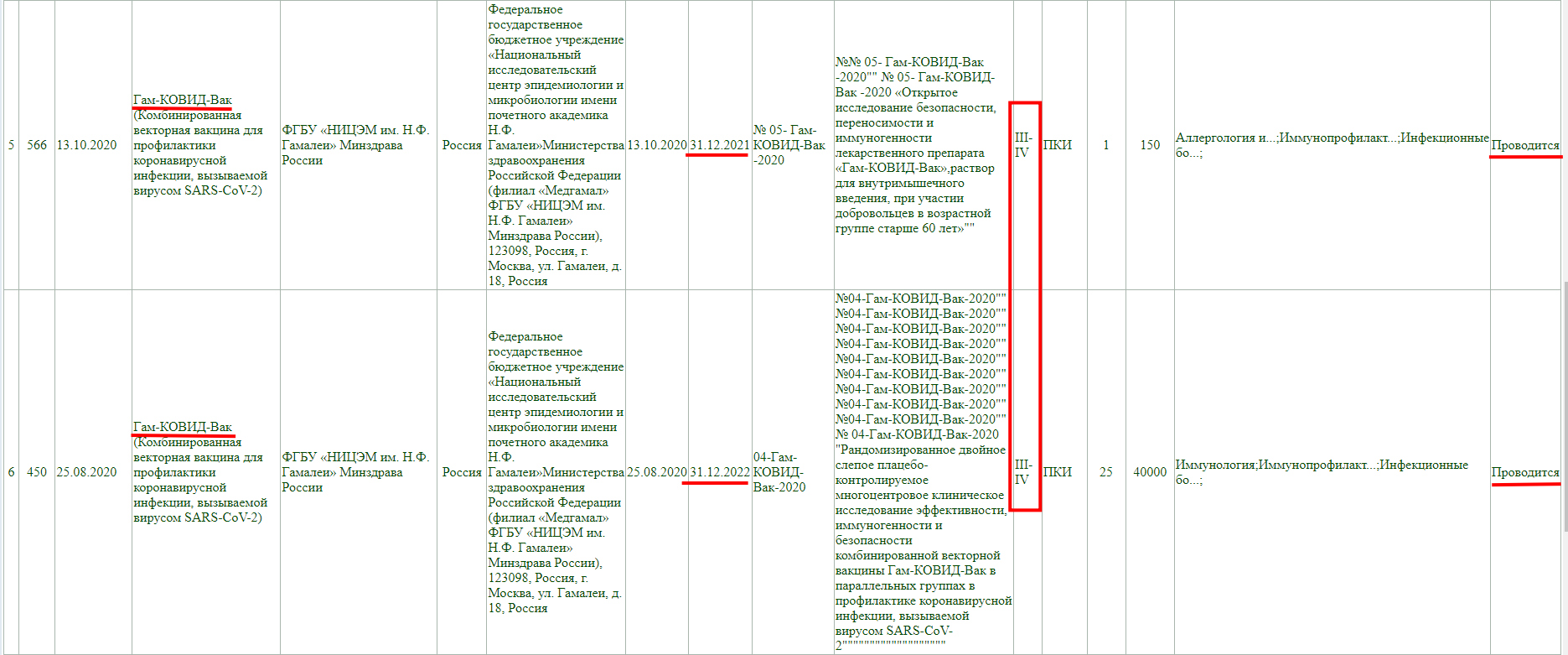
Тут аналогично, клинические исследования не завершены, проводится фаза 3-4, и завершится она 30 декабря 2022 года.
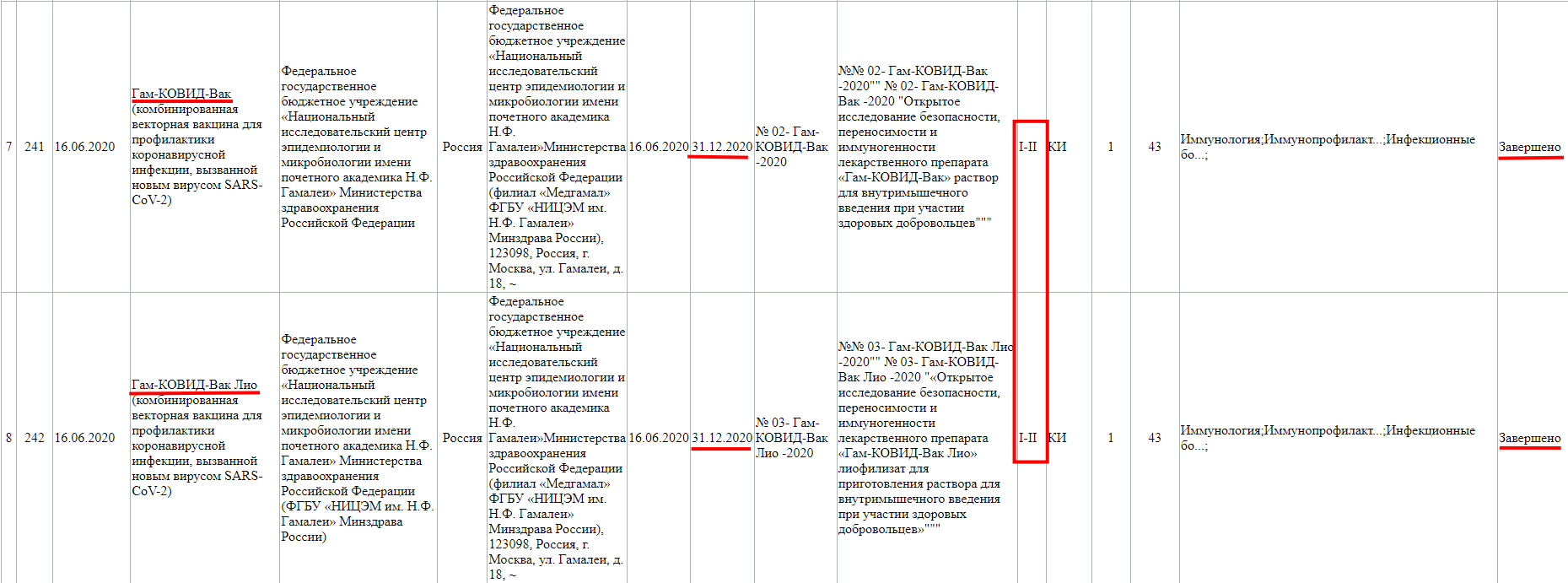
А тут клиническое исследование завершено, но только фазы 1-2.
Кроме того, отсутствие данных о клинических испытаниях вакцины «Спутник V» необходимых для ее регистрации в Европе, 15 мая 2021 года, уже сообщало одно из крупнейших в мире международных агентств новостей и финансовой информации, Reuters.
И в завершение, по данным ВОЗ на 14 марта 2021 г., российские вакцины против COVID-19, в перечне безопасных и эффективных, отсутствуют.
Читайте также: Заведующая ковид-отделением: «Когда заболел пятилетний сын, я запаниковала»